[서울=뉴스핌] 김근희 기자 = 앞으로 인공지능(AI), 3D프린팅 등 혁신의료기술이 시장에 빨리 진입할 수 있도록 돕는 별도의 평가 과정이 생긴다. 기존 평가기간도 단축된다.
| [이미지=보건복지부] |
앞서 정부는 지난해 7월 '의료기기 규제혁신 및 산업육성방안'(이하 의료기기 규제혁신 방안)을 통해 AI, 3D 프린팅, 로봇 등 첨단기술이 융합된 혁신의료기술에 대해서는 기존의 의료기술평가 방식이 아닌 별도의 평가트랙을 도입하겠다고 발표한 바 있다.
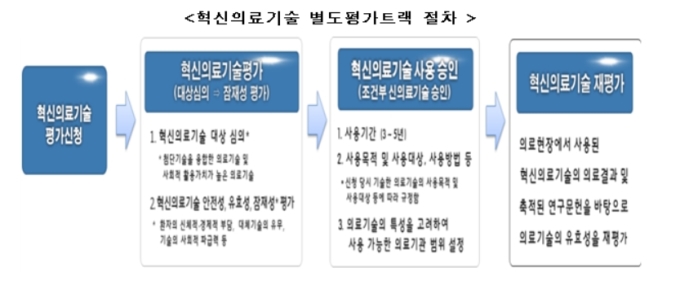
개정된 법령에 따르면 혁신의료기술 별도평가트랙이 도입된다. 첨단기술이 융합된 의료기술 및 암, 심장질환 등 중증 질환을 치료하는 사회적 활용가치가 높은 의료기술은 기존의 신의료기술평가가 아닌 별도 평가트랙을 활용할 수 있게 된다.
그동안 새로운 의료기술이 적용된 제품들이 시장에 나오기 위해서는 식품의약품안전처의 판매 허가와는 별도로 신의료기술평가를 거쳐야 했다. 신의료기술평가는 문헌을 근거로 의료기술의 안전성과 유효성을 평가한다. 신의료기술평가 때문에 의료기술이 시장에 나오는 시기가 늦어져 의료기술 발전을 저해할 수 있다는 지적이 있었다.
이에 복지부와 한국보건의료연구원은 의료기술의 사회적 가치 및 잠재성을 평가하는 방법을 연구해 기존의 문헌 중심의 평가체계를 보완하는 잠재성 평가방법을 개발했다. 이번에 도입되는 혁신의료기술 별도평가트랙에서는 기존의 문헌 평가와 더불어 새로 개발된 의료기술의 잠재성 평가까지 진행한다.
기존의 평가체계에서 유효성을 평가할 문헌이 부족해 탈락했던 의료기술 중 환자의 삶을 획기적으로 개선하거나 환자의 비용 부담을 줄여주는 등 높은 잠재성을 가졌을 경우, 조기 시장 진입이 허용된다. 다만, 혁신의료기술이라 하더라도 침습적 의료행위로 환자의 부담이 큰 의료기술에 대해서는 문헌을 통한 엄격한 안전성 검증을 실시한다.
혁신의료기술 별도평가트랙을 통해 의료현장에 도입된 혁신의료기술은 의료현장에서 활용된 결과를 바탕으로 3~5년 후 재평가를 받아야 한다. 혁신의료기술을 개발한 의료기기 업체 등은 이를 사용하는 의료기관 및 실시 의사, 재평가를 위해 수집되는 자료 등을 한국보건의료연구원에 제출해야 한다.
| [이미지=보건복지부] |
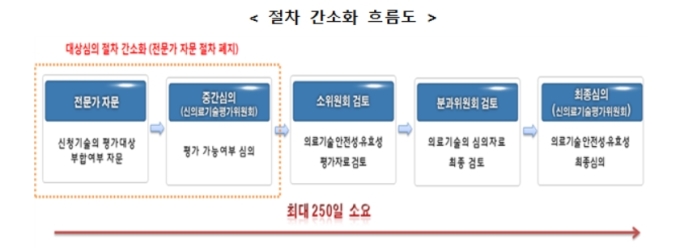
전문가 서면 자문을 통해 신의료기술평가 대상 여부를 판단했던 절차를 내부 평가위원으로 대체한다. 2단계의 평가절차를 1단계로 줄인 것이다. 외부 전문가 탐색 및 구성 등에 발생했던 시간을 절약한다.
손호준 보건복지부 의료자원정책과장은 "혁신의료기술 별도평가트랙의 도입을 통해 그간 늦어졌던 혁신의료기술의 활용을 촉진하되, 의료기술의 안전성은 엄격히 검증할 예정"며 "그동안 다소 긴 평가기간으로 인해 어려움을 호소했던 의료기기 업체들의 부담도 줄어들 것"이라고 말했다.
keun@newspim.com